
Individuazione di un modello collaborativo regionale per la definizione del ruolo in terapia delle innovazioni farmacologiche in oncologia utilizzando il metodo GRADE
CONTESTO
La politica del farmaco rappresenta una delle priorità in ambito regionale, non solo per le evidenti ripercussioni economiche che la spesa farmaceutica ha nei bilanci delle Regioni, ma soprattutto per garantire ai cittadini/pazienti un’assistenza d’eccellenza. I farmaci oncologici, nella Regione Friuli Venezia Giulia, come nelle altre regioni italiane, hanno l’impatto economico maggiore nell’ambito delle risorse che le Regioni destinano alla spesa farmaceutica. Le recenti acquisizioni nel campo della ricerca hanno consentito lo sviluppo di innovative molecole per la terapia dei tumori che avranno nell’immediato futuro, riflessi significativi nel campo clinico/assistenziale ed economico. L’utilizzo in ambito Nazionale dei farmaci è “normato” dalle disposizioni dell’Agenzia Italiana del Farmaco (AIFA). Tuttavia, l’impiego dei medicinali, fra le varie Regioni Italiane, come evidenziato dalla spesa farmaceutica pro-capite, rileva notevoli variabilità in termini di consumi e spesa. Le regioni più “virtuose” sembrano essere quelle dotate di efficienti strumenti di indirizzo per l’uso appropriato dei farmaci mediante la definizione del costo/efficacia della terapia che si avvale di metodi di condivisione multidisciplinare e di analisi critica.
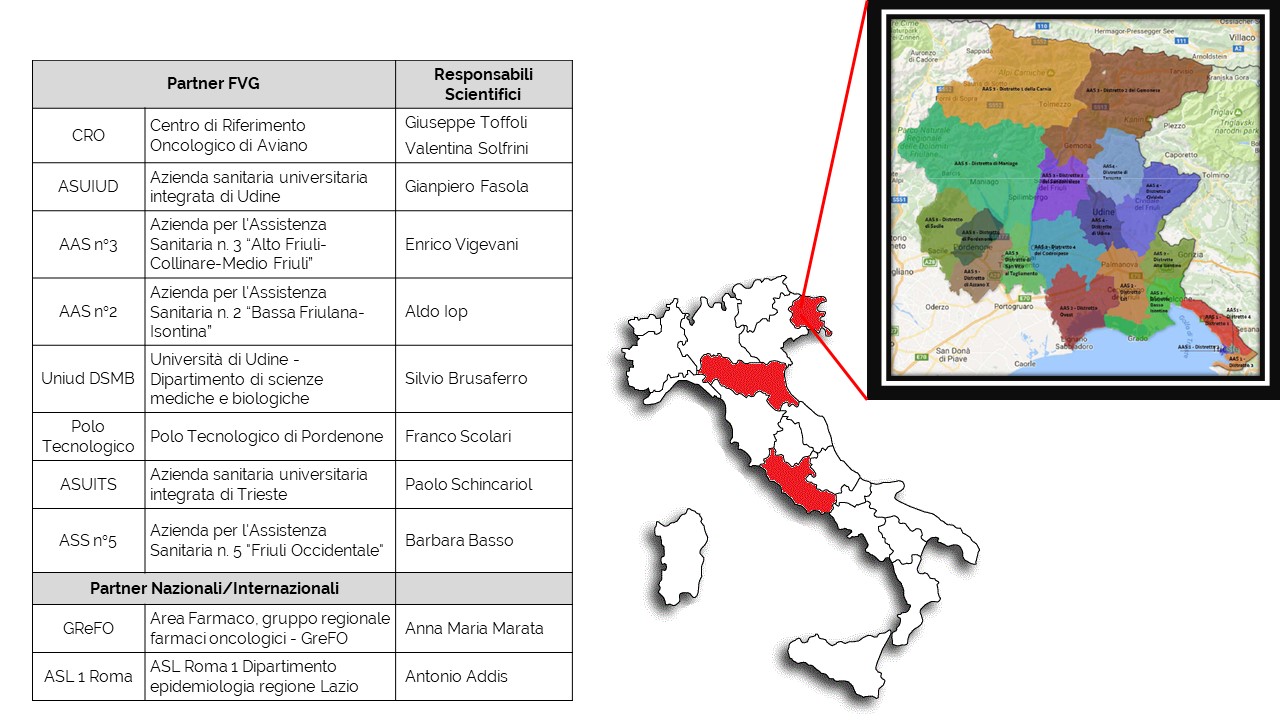
Il progetto FOIFVG (Farmaci Oncologi Innovativi Friuli Venezia Giulia), finanziato nel 2017 con fondi di ricerca della regione FVG, ha l’ambizione di creare una rete multidisciplinare di professionisti quali medici, farmacisti, metodologi e rappresentanti dei pazienti, per stabilire il ruolo in terapia dei nuovi farmaci rispetto alle alternative esistenti considerando anche il costo a parità di efficacia clinica. Il gruppo FOIFVG è coordinato dal dr. Giuseppe Toffoli e dalla dr.ssa Valentina Solfrini, ma prevede la partecipazione di tutti i direttori delle oncologie, onco-ematologie e farmacie ospedaliere della Regione.
OBIETTIVI
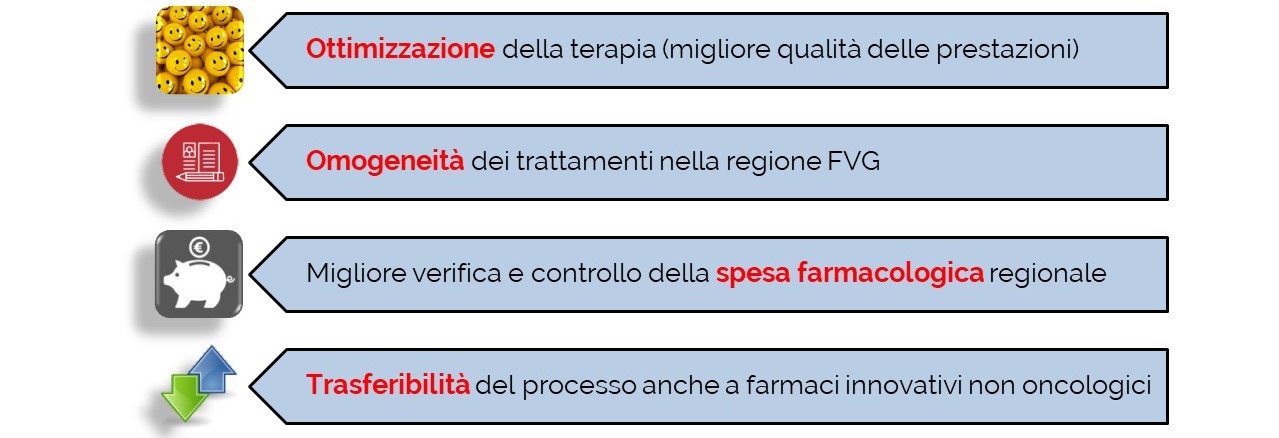
L’obiettivo principale è quello di studiare, sperimentare e validare un modello organizzativo per l’uso condiviso ed economicamente sostenibile di farmaci oncologici di recente introduzione, mediante un processo trasparente e strutturato che porti a specifiche raccomandazioni per uniformarne l’utilizzo in Regione Friuli Venezia Giulia.
Il modello è già stato sperimentato con successo e gradimento in Veneto e in Emilia-Romagna, garantendo un riequilibrio delle risorse tra le diverse realtà regionali, una pianificazione calibrata sui reali bisogni del paziente e un miglior coordinamento fra gli enti del Servizio Sanitario Regionale. L’organizzazione proposta pone la persona al centro di una rete di professionisti consentendo un uso ottimale delle risorse e garantendo terapie appropriate e all’avanguardia.
Infine, il modello ed i processi sviluppati potranno diventare un supporto regionale, anche per i farmaci innovativi non oncologici.
METODOLOGIA
Le aziende partner del progetto FOIFVG sono impegnate a definire il modello gestionale, partecipando ai vari gruppi di lavoro per la ricerca, lo studio e l’implementazione della metodologia, a valutarne l’impatto e a diffonderne i risultati. Il processo che porta alle raccomandazioni consente il confronto sulla base di dati scientifici aggiornati dei farmaci di recente introduzione e delle personali aspettative dei pazienti. Il modello organizzativo studiato, sperimentato e validato a livello regionale, vuole essere uno strumento per ottimizzare le terapie per tutti i pazienti della Regione Friuli Venezia Giulia grazie ad un trattamento omogeneo di alto livello, per una terapia di “precisione”.
Il punto di partenza: IL METODO GRADE
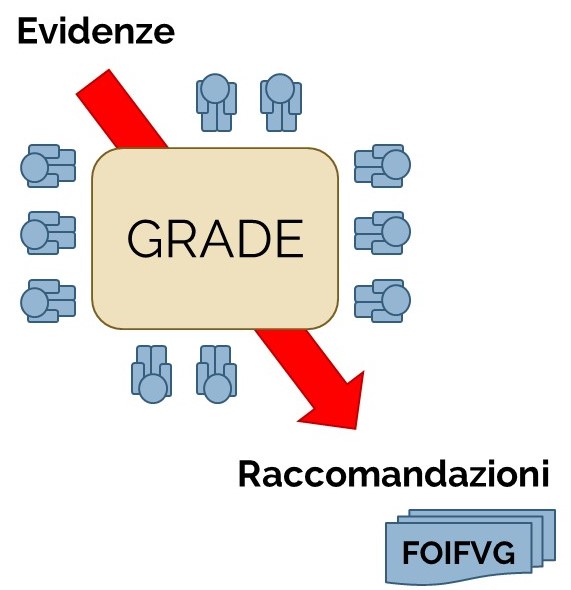
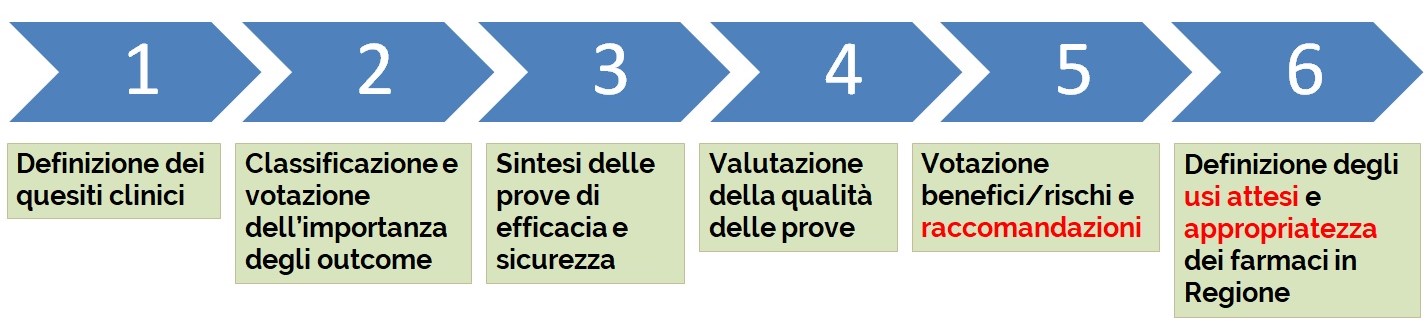
Il gruppo di lavoro FOIFVG nel definire un efficiente ed efficace modello organizzativo ha adottato il metodo GRADE (Grading of Recommendations, Assessment, Development and Evaluation) per fornire raccomandazioni basate sulle prove di efficacia e sicurezza dei farmaci oncologici di recente introduzione e rimborsati dal Sistema Sanitario Nazionale, al fine di suggerirne il posto in terapia ed individuarne gli usi appropriati nella pratica clinica.
Il metodo GRADE1,2 prevede, in merito alla valutazione della qualità delle prove di efficacia e sicurezza, di procedere per gradi valutando nell’ordine:
- Importanza degli esiti di efficacia e sicurezza
- Qualità metodologica delle prove
- Bilancio fra i benefici ed i rischi ricavati dalle prove di efficacia e sicurezza
- Formulazione della raccomandazione
Il gruppo di lavoro ha deciso che i passaggi 1, 3 e 4 prevedano una votazione.
1. Importanza degli esiti di efficacia e sicurezza
Il metodo adottato dal gruppo FOIFVG prevede la definizione dell’importanza dei possibili esiti di efficacia per ogni singola patologia neoplastica oggetto di studio e di sicurezza per ogni singolo farmaco3 con indicazione registrata e rimborsata per la patologia in analisi. Tale importanza viene definita mediante una votazione con un punteggio da 1 a 9, che consente di classificare gli esiti in:
- – non importanti (punteggio da 1 a 3)
- – importanti (punteggio da 4 a 6)
- – critici o essenziali (punteggio da 7 a 9)
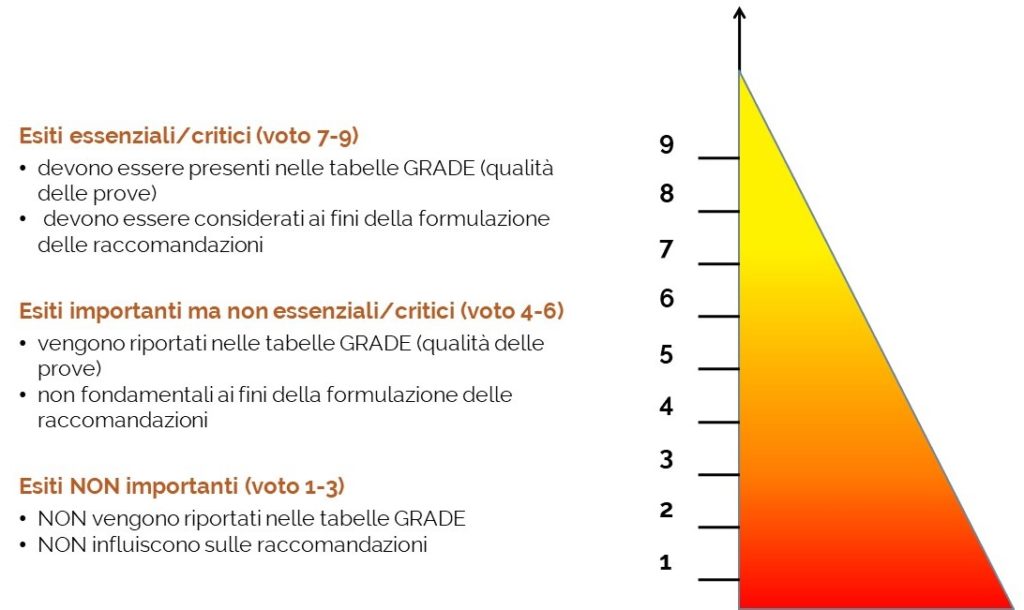
Solo gli esiti risultati importanti o critici/essenziali vengono poi ricercati negli studi clinici ed i relativi risultati vengono considerati per la definizione della raccomandazione4.
2. Qualità metodologica delle prove
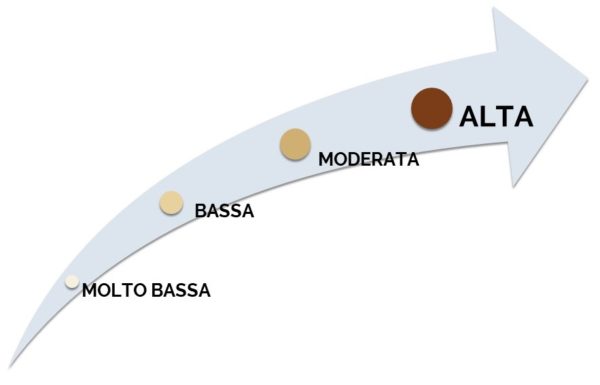
La qualità delle prove di efficacia è definita, per singolo esito, in quattro categorie5:
- – alta
- – moderata
- – bassa
- – molto bassa
Partendo da una qualità teoricamente “alta” di uno studio randomizzato controllato, vengono sistematicamente considerati una serie di fattori che possono ridurne la qualità:
- validità interna dello studio (risk of bias)6,7
- coerenza tra studi (inconsistency)8
- non trasferibilità nella pratica clinica (indirectness)9
- stime imprecise (imprecision e sparse data)10
- possibilità di pubblicazione selettiva dei dati (publication/reporting bias)11

In base al numero di fattori presenti e all’importanza dei limiti metodologici la qualità può subire un downgrading fino a diventare molto bassa.
Al contrario, partendo dalla qualità teoricamente “bassa” di uno studio osservazionale è possibile un innalzamento di tale qualità in presenza dei seguenti fattori12:
- associazione intervento-outcome (dimensione dell’effetto)
- gradiente dose-risposta
- effetto visibile nonostante possibili fattori di confondimento e bias

3. Bilancio fra i benefici ed i rischi
Se la qualità è diversa fra i singoli outcome essenziali, il metodo suggerisce di utilizzare come qualità delle evidenze quella relativa all’outcome critico che ha ricevuto il giudizio più basso13,14.
Il gruppo FOIFVG ha deciso di non considerare le prove di efficacia dei risultati presentati a congressi in forma di abstract o comunicazioni orali, ma ha ritenuto opportuno valutare solamente i dati dei lavori pubblicati su riviste scientifiche indicizzate o i documenti delle agenzie regolatorie con particolare riferimento ai documenti prodotti dall’Agenzia Europea per i Medicinali (EMA).
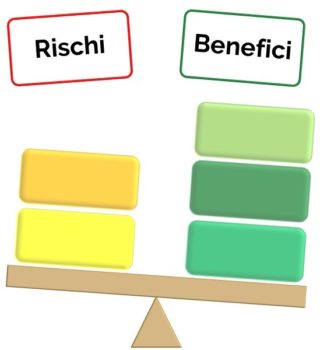
Il metodo prevede che, una volta esaminate le prove di efficacia e sicurezza, venga votato il rapporto tra i
benefici e i rischi15. Tale rapporto potrà essere definito come:
- – favorevole (prevalgono i benefici),
- – incerto
- – sfavorevole (prevalgono i rischi)
4. Formulazione della raccomandazione
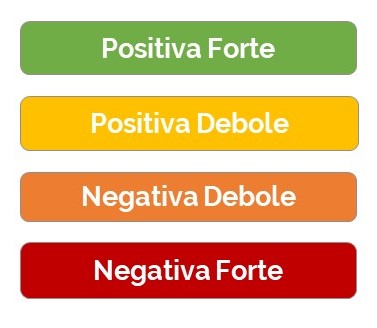
Ultimo passaggio è quello della formulazione della raccomandazione che sono prodotte tenendo in considerazione l’entità dei benefici e dei rischi e la qualità delle prove. Le raccomandazioni potranno essere di entità debole o forte e di verso positivo o negativo17,18:
- – positiva forte
- – positiva debole
- – negativa debole
- – negativa forte
MATERIALI PER CORSO ECM
DALLE PROVE DI EFFICACIA ALLE RACCOMANDAZIONI. CORSO PER MEDICI E FARMACISTI SULL’USO DELL’EBM NELLA GESTIONE DEI FARMACI INNOVATIVI
Materiale per il corso da scaricare:
– Obiettivi didattici e metodologia / Dr.ssa Anna Maria Marata
– Linee guida secondo metodo GRADE / Dr. Francesco Nonino
– Ruolo e limiti degli studi non randomizzati / Dr. Giulio Formoso
– Esercitazione 1 / Dr.ssa Anna Maria Marata
– Pillole di statistica, parte 1 / Dr. Giulio Formoso
– Esercitazione 2, Interpretazione dei risultati / Dr. Roberto D’Amico
– Esercitazione 2, Consort statement / Dr.ssa Lucia Magnano
– Pillole di statistica, parte 2: Analisi per sottogruppi / Dr. Roberto D’Amico
– Esercitazione 3, Analisi per sottogruppi / Dr. Giulio Formoso
– Superiorità, equivalenza, non inferiorità / Dr.ssa Anna Maria Marata
– Revisioni sistematiche / Dr. Roberto D’Amico
– Il bias di pubblicazione / Dr. Roberto D’Amico
– Esercitazione 6, Raccomandazioni / Dr.ssa Anna Maria Marata
– Materiale di supporto: consort
– Materiale di supporto: consort
– Materiale di supporto: GRADE
– Materiale di supporto: studi di non inferiorità
– Materiale di supporto: validità interna ed altro
Per approfondimenti visitare: http://www.consort-statement.org/
BIBLIOGRAFIA
- “GRADE home.” [Online]. Available: http://www.gradeworkinggroup.org/#pub. [Accessed: 18-May-2017].
- Guyatt et al., “GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables,” J. Clin. Epidemiol., vol. 64, no. 4, pp. 383–394, Apr. 2011.
- H. Guyatt et al., “GRADE guidelines: 2. Framing the question and deciding on important outcomes,” Clin. Epidemiol., vol. 64, no. 4, pp. 395–400, Apr. 2011.
- Guyatt et al., “GRADE guidelines: 11. Making an overall rating of confidence in effect estimates for a single outcome and for all outcomes,” J. Clin. Epidemiol., vol. 66, no. 2, pp. 151–157, Feb. 2013.
- Balshem et al., “GRADE guidelines: 3. Rating the quality of evidence,” J. Clin. Epidemiol., vol. 64, no. 4, pp. 401–406, Apr. 2011.
- H. Guyatt et al., “GRADE guidelines: 4. Rating the quality of evidence–study limitations (risk of bias),” J. Clin. Epidemiol., vol. 64, no. 4, pp. 407–415, Apr. 2011.
- H. Guyatt et al., “GRADE guidelines 17: assessing the risk of bias associated with missing participant outcome data in a body of evidence,” J. Clin. Epidemiol., May 2017.
- H. Guyatt et al., “GRADE guidelines: 7. Rating the quality of evidence–inconsistency,” J. Clin. Epidemiol., vol. 64, no. 12, pp. 1294–1302, Dec. 2011.
- H. Guyatt et al., “GRADE guidelines: 8. Rating the quality of evidence–indirectness,” J. Clin. Epidemiol., vol. 64, no. 12, pp. 1303–1310, Dec. 2011.
- H. Guyatt et al., “GRADE guidelines 6. Rating the quality of evidence–imprecision,” J. Clin. Epidemiol., vol. 64, no. 12, pp. 1283–1293, Dec. 2011.
- H. Guyatt et al., “GRADE guidelines: 5. Rating the quality of evidence–publication bias,” J. Clin. Epidemiol., vol. 64, no. 12, pp. 1277–1282, Dec. 2011.
- H. Guyatt et al., “GRADE guidelines: 9. Rating up the quality of evidence,” J. Clin. Epidemiol., vol. 64, 12, pp. 1311–1316, Dec. 2011.
- H. Guyatt et al., “GRADE guidelines: 12. Preparing summary of findings tables-binary outcomes,” J. Clin. Epidemiol., vol. 66, no. 2, pp. 158–172, Feb. 2013.
- H. Guyatt et al., “GRADE guidelines: 13. Preparing summary of findings tables and evidence profiles-continuous outcomes,” J. Clin. Epidemiol., vol. 66, no. 2, pp. 173–183, Feb. 2013.
- Brunetti et al., “GRADE guidelines: 10. Considering resource use and rating the quality of economic evidence,” J. Clin. Epidemiol., vol. 66, no. 2, pp. 140–150, Feb. 2013.
- J. Schünemann et al., “GRADE Guidelines: 16. GRADE evidence to decision frameworks for tests in clinical practice and public health,” J. Clin. Epidemiol., vol. 76, pp. 89–98, Aug. 2016.
- Andrews et al., “GRADE guidelines: 14. Going from evidence to recommendations: the significance and presentation of recommendations,” J. Clin. Epidemiol., vol. 66, no. 7, pp. 719–725, Jul. 2013.
- C. Andrews et al., “GRADE guidelines: 15. Going from evidence to recommendation-determinants of a recommendation’s direction and strength,” J. Clin. Epidemiol., vol. 66, no. 7, pp. 726–735, Jul. 2013.
